Kirkland Calcium Vitamin D
информация для специалистов
Кости, кальций и витамин D (точка эрения эндокринолога)
В последние десятилетия особенно актуальна проблема остеопороза, его распространенности, что обусловлено старением населения, ростом, улучшающимися возможностями диагностики, негативным влиянием на продолжительность и качество жизни и др. [1, 9, 13, 43].
Поскольку остеопороз — системное заболевание скелета, характеризующееся снижением массы кости в единице объема и нарушением микроархитектоники костной ткани, очевидно, что костная масса является основной детерминантой механических свойств костной ткани и определяет 75–80% ее прочности. Кроме того, прочность кости зависит от ее качества, которое обусловлено геометрией строения, минерализацией, состоянием органического матрикса, микроповреждениями, сбалансированностью процессов резорбции старой кости и образования новой. Под влиянием различных факторов, таких, как наследственность, расовая принадлежность, питание, физическая активность, вредные привычки, менструальный статус у женщин, прочность кости может снижаться.
Формирование кости происходит в ранние годы жизни — с момента рождения и до наступления зрелости. В детстве, подростковом возрасте и ранней юности костная масса увеличивается. Ее рост прекращается, когда достигается пиковое значение. Время достижения пиковой костной массы варьируется в зависимости от пола, области скелета возраста полового созревания и колеблется в пределах от 17–18 и до 30 лет. Важнейшим компонентом кости является кальций, входящий в состав гидроксиапатита и определяющий жесткость и механическую прочность скелета. Кроме того, роль кальция не ограничивается регулированием прочности кости, так как он принимает участие в целом ряде других физиологических функций :
· Минерализации зубов;
· Является внутриклеточным трансмиттером;
· Регуляция нейромышечной трансмиссии;
· Сокращении мышц (включая миокард);
· Регуляции экзо- и эндокринной секреции (гормоны, ферменты, белки);
· Регуляции свертывания крови;
· Рост и дифференцировка клеток.
Перечисленные эффекты кальция позволяют определить его как важнейший макроэлемент, гомеостаз которого определяет многие жизненные функции. Гомеостаз кальция – сложный и многофакторный процесс, определяющийся поступлением с продуктами питания, всасыванием и утилизацией под влиянием целого ряда кальций-регулирующих веществ (в первую очередь - гормонов). При этом кальций не является инертным макроэлементом и может вступать в различные взаимодействия с другими веществами.
Потребление кальция с пищей составляет в среднем 1000 – 1300 мг/сут, из которых в желудочно-кишечном тракте абсорбируется 200-400 мг [32]. Поскольку элиминация кальция из организма осуществляется главным образом с мочой, у взрослого человека без дефицита кальция не менее 200 мг элемента должно экскретироваться почками.
В человеческом организме находится около 1000 г кальция, из них около 99% содержится в скелете в форме гидроксиапатита и 0,5-1% находится во внеклеточной жидкости и мягких тканях. Содержание кальция во внеклеточной жидкости находится под строгим гормональным контролем и весьма стабильно. В сыворотке кальций представлен тремя фракциями: приблизительно 40 % от общего количества (10 мг/дл) связано с белком, 10 % - с цитратом, бикарбонатом и фосфатом, а 50 % приходится на свободную фракцию (ионизированный кальций - Са2+), обладающую наибольшей биологической активностью. На концентрацию ионов кальция большое влияние оказывает содержание белков в сыворотке крови и основным белком, связывающим кальций, является альбумин. Концентрация ионов кальция во внеклеточной жидкости является постоянной в результате взаимодействия процессов непрерывного поступления и выхода кальция из нее. Кальций поступает в плазму вследствие его всасывания в кишечнике и резорбции кости, а покидает внеклеточную жидкость с секретом желудочно-кишечного тракта, мочой, путем отложения в костной ткани и в небольшом количестве с потом. В клетку кальций поступает, по-видимому, через кальциевые каналы, а из клеток удаляется Ca2+-Na+ сопереносчиком или Са2+-помпой. Значительное количество кальция реабсорбируется и парацеллюлярно. В дистальных канальцах реабсорбция кальция диссоциирована от всасывания натрия и происходит против концентрационного градиента. Через клетку, не увеличивая внутриклеточное содержание Са2+, реабсорбируемый кальций переносится посредством зависимого от витамина D Са2+-связывающего белка. Из поступающего с пищей кальция у взрослого человека в кишечнике всасывается менее 50%; у детей в период быстрого роста, у женщин при беременности и лактации всасывание кальция увеличивается, а у пожилых людей снижается. Основная часть кальция всасывается в проксимальных отделах тонкого кишечника путем активного транспорта, в более дистальных отделах эффективность всасывания кальция снижается и идет за счет ограниченной диффузии; на оба эти процесса влияют активные метаболиты витамина D3. Секреция кальция в просвет кишечника постоянна и не зависит от его всасывания, она составляет 0,1–0,2 г кальция в сутки, и только в случае достаточного потребления его с пищей эти потери можно компенсировать.
У здоровых взрослых экскреция кальция с мочой составляет около 0,1-0,4 г в сутки и снижется при недостаточном потреблении кальция до 70%. Поддержание положительного баланса кальция зависит от интенсивности его всасывания в кишечнике, уровня паратиреоидного гормона и D-гормона (витамина D). При нарушении возможно развитие отрицательного кальциевого баланса с активизацией костной и резорбции и развитием нарушений минеральной плотности кости (МПК). Процесс костного ремоделирования сопровождается использованием 0,5мг кальция скелетом (кости скелета поглощают и выделяют примерно по 0,5 мг кальция). Основным источников поступления кальция в организм является пища. Рекомендуемые уровни потребления кальция в зависимости от возраста и периода жизни представлены в таблице. По результатам исследований, оценивающих потребление кальция взрослым населением различных стран, отмечено, что в среднем его потребление не превышает 700-800 мг в сутки [3], что существенно ниже рекомендуемых нормативов.
Рекомендуемое оптимальное потребление кальция (мг/сут. ) в различные периоды жизни (NAS, 2002)
| Возрастные и физиологические периоды | Потребление кальция |
| Новорожденные и дети до 6 мес. | 210 |
| Дети 6 мес – 1 год | 270 |
| Дети 1–3 года | 500 |
| Дети 4–8 лет | 800 |
| Дети 9–13 лет и подростки 14-18 лет | 1300 |
| Взрослые 19–50 лет | 1000 |
| Взрослые 51 и старше | 1200 |
| Беременные и кормящие женщины: | |
| 14–18 лет | 1300 |
| 19–50 лет | 1000 |
В клинической практике для расчтерта суточного потртебления кальция с пищей рекомендуется следующая формула:
Суточное потребление кальция (мг) = Кальций молочных продуктов (мг)* + 350 мг
* рассчитывается из соответствующих таблиц
Согласно Рекомендациям Американского Национальной организации остеопороза 2008 года рекомендуется нижеследующая формула для расчета потребления кальция [16]:
Суточное потребление кальция (мг) = Кальций молочных продуктов (мг)* + Кальций из обогащенных продуктов и соков + 250 мг
* рассчитывается из соответствующих таблиц
Существующие рекомендации по профилактике и лечению остеопороза базируются на фундаментальном принципе - облигатном использовании кальция и D гормона (витамина Д) [9, 13, 16, 26] но клиницисты все чаще задаются вопросами о безопасности препаратов кальция с позиций их влияния на другие органы и системы и о предпочтительности выбора рекомендаций по питанию или определенной соли кальция для включения в комплексное лечение в течение длительного времени.
Что же сегодня известно о препаратах кальция?
В существующих клинических рекомендациях утверждается, что адекватное потребление кальция с пищей способствует поддержанию достаточной плотности костной ткани; кроме того, кальций усиливает антирезорбтивный эффект эстрогенов на кости [9, 13, 16, 23, 26]. Полноценное потребление кальция в детстве и подростковом возрасте является наиболее важным фактором для достижения оптимальной массы костей и их размера, а недостаток кальция в период роста организма приводит к снижению пика костной массы, что может стать причиной повышенного риска переломов даже у молодых [11, 46]. Имеются данные, что МПК у взрослых женщин находится в прямой зависимости от потребления молока и молочных продуктов в детстве и юности, а прироста пика костной массы на 5-10% можно достичь за счет достаточного потребления кальция в раннем возрасте, что позволяет снизить риск перелома бедра в течение последующей жизни на 25-50% [13, 41].
Поскольку кальций способен утилизироваться только при наличии адекватного количества D-гормона, облигатной составляющей большинства препаратов кальция являются его различные производные. Очевидно, что исследования, оценивающие эффективность препаратов кальция, неразрывно связаны и с исследованиями по эффективности использования витамина D [10,14,37].
Метаанализ 6 исследований, включающих наблюдение за 45509 менопаузальными женщинами, получавшими кальций и витамин D3 в сравнении с плацебо выявил снижение риска переломов на 18% [10]. В этом же метаанализе при сравнении эффективности кальция и витамина D3 с монотерапией витамином D3 отмечено снижение риска переломов бедра на 28% и внепозвоночных переломов - на 23%. Аналогичные результаты получены и в других исследованиях [5, 6, 22, 23, 55], где отмечено, что у женщин в поздней постменопаузе с низким употреблением пищевого кальция прием солей кальция замедляет потерю костной ткани в позвоночнике, шейке бедра и предплечье и снижает скорость потери костной ткани проксимального отдела бедра и всего тела. В то же время, Riggs и соавт. не выявили различий в частоте переломов с группой плацебо.
В 2007 году опубликованы результаты нескольких метаанализов по оценке эффективности использования солей кальция и витамина D для предупреждения остеопоротических переломов [5, 7,10, 60]. Выводы из этих публикаций свидетельствуют, что:
• наиболее эффективной дозой кальция для снижения риска переломов является доза 1000-1200 мг/сут, а витамина D - 800 ME;
• низкое потребление кальция в рационе и добавки кальция в дозе более 1200 мг/сут обеспечивают максимальный эффект;
• при использовании адекватных доз кальция и витамина D отмечается снижение риска переломов бедра и других невертебральных переломов на 12-26%;
• недостаточно данных для оценки результатов по переломам позвоночника;
• эффект снижения риска переломов не зависит от пола пациентов и наиболее выражен у лиц старшего возраста;
• следует избегать передозировки витамина D, но рекомендуемый сывороточный уровень витамина D - более 75 нмоль/л [5,7,10,60].
В то же время, традиционно молоко и молочные продукты - один из самых недорогих источников кальция, но использование молока ограничивается:
• вкусовыми потребностями людей;
• снижением активности кишечных лактаз с увеличением возраста, что сопровождается снижением утилизации кальция из молочных продуктов.
Вопросы, касающиеся безопасности использования препаратов кальция у взрослых, включают:
• оценку переносимости лекарственных средств;
• наличие или отсутствие лекарственных взаимодействий;
• влияние на камнеобразование;
• влияние на внескелетные кальцификации и кардиоваскулярную патологию;
• влияние на исходы беременности.
Препараты кальция: противопоказания и переносимость
Противопоказания к назначению препаратов кальция включают гиперкальциемию и гиперкальцийурию более 300 мг/сут, т. е. подавляющее большинство потенциальных пациентов не имеют противопоказаний для использования препаратов кальция. Основные причины гиперкальциемии включают:
• солидные опухоли, в том числе с метастазами в кости;
• гематологические неопластические процессы (множественная миелома, лимфома, лейкоз);
• гиперпаратиреоз различной этиологии, в том числе при хронической болезни почек;
• гипертиреоз;
• длительную иммобилизацию;
• саркоидоз и другие грануломатозы;
• передозировку витамина D;
• длительный прием тиазидных диуретиков или препаратов лития;
• интоксикацию витамином А;
• интоксикацию алюминием;
• семейную гипокальцийурическую гиперкальциемию;
• идиопатическую гиперкальциемию у детей;
• молочно-щелочной синдром.
Препараты кальция могут быть классифицированы следующим образом:
• монопрепараты кальция (содержащие только соли кальция);
• комбинированные препараты, содержащие витамин D3 ;
• комплексные препараты, которые кроме кальция и витамина D3 содержат микроэлементы с потенциально позитивными влияниями на костный метаболизм.
В таблице 2 приведены сведения по содержанию кальция в используемых солях.
Таблица 2. Содержание элементарного кальция в некоторых солях кальция (мг/г)
| Соль кальция | Содержание элементарного кальция |
| Карбонат | 400 |
| Хлорид | 270 |
| Фосфат,двухосновной ангидрид | 290 |
| Фосфат,двухосновной дигидрид | 230 |
| Фосфат трехосновной | 400 |
| Глицерофосфат | 191 |
| Лактат | 130 |
| Цитрат | 210 |
| Глюконат | 90 |
Следует учитывать различия в биодоступности различных солей кальция: максимальное количество ионизированного кальция образуется при использовании карбонатной соли (40%), а минимальное - при использовании глюконата (9%).
Наиболее употребляемыми солями кальция являются карбонат и цитрат. Карбонат кальция является лидером по содержанию элементарного кальция в 1 грамме соли (400 мг), при приеме с едой карбонат кальция хорошо всасывается даже у пожилых лиц и пациентов с атрофическим гастритом, а его биодоступность не отличается от таковой для цитрата кальция при одновременном приеме с пищей [30, 50]. В то же время, точка зрения, постулирующая снижение всасывания кальция при гипо- и анацидных состояниях из карбонатной соли, продолжает свое существование.
Обе указанные соли кальция одинаково эффективно влияют на показатели костного метаболизма и уровень кальция в крови, имеют сходные фармакокинетические параметры [31, 34]. При этом карбонат кальция рекомендуется принимать для оптимизации всасывания во время еды, а цитратную соль можно использовать без связи с приемом пищи. В то же время доказано, что цитрат кальция может повышать усвоение алюминия из питьевой воды и из лекарственных препаратов, поэтому при выборе цитратной соли кальция необходимо учитывать потребление алюминийсодержащих препаратов (например, антацидов) [17].
В последние годы появилась тенденция к использованию «природных» лекарственных средств, нашедшая свое применение в препаратах кальция, в частности, устричного кальция (кальция, полученного из раковин моллюсков) и костной муки. Основным фактором, лимитирующим широкое распространение таких препаратов, является высокая частота выявления токсических примесей (соединений свинца, алюминия и др.). Несмотря на снижение нормативов содержания примесей, Комиссией по продуктам питания и лекарственным препаратам США выявлено, что «натуральные» препараты по-прежнему могут содержать превышающие разрешенные нормативы количества примесей. Это обусловливает ограничение использования «натуральных» препаратов кальция у детей, беременных и лактирующих женщин, особенно в сочетании с алюминийсодержащими антацидами. Риск интоксикации алюминием наиболее актуален:
• для беременных и лактирующих женщин, так как связан с возможным развитием внутриутробных пороков развития и патологией центральной нервной и репродуктивной систем;
• для пожилых, в связи с увеличением риска энцефалопатии;
• при наличии терминальной стадии хронической болезни почек.
Избыток алюминия в костной ткани приводит к угнетению функции остеобластов и нарушению минерализации костного матрикса, вызывает резистентность к препаратам кальция и витамина D, вследствие чего может инициировать гиперкальциемию, что определяет ограничения при назначении алюминийсодержащих препаратов. В то же время, при отсутствии сочетания приема алюминия и солей цитрата кальция, соли цитрата кальция обеспечивают адекватное поступление и эффекты макроэлемента. Более того, существуют исследования, свидетельствующие об отсутствии накопления алюминия при сочетанном приеме с цитратными солями калия или кальция у больных с нормальной функцией почек.
Пищевое поступление кальция считается оптимальным с позиций его естественности, однако всасывание кальция из пищевых продуктов лимитировано воздействием целого ряда факторов:
• адекватное, но не избыточное, потребление белка (избыточное потребление белка усиливает кальцийурию);
• потребление поваренной соли (избыточное использование соли сопровождается уменьшением МПК);
• употребление большого количества кофе (более 4 чашек в день);
• избыточное употребление алкоголя (в пересчете на чистый спирт более 15 г для женщин и более 30 г для мужчин);
• оксалаты и фитаты замедляют всасывание кальция [24, 25].
Кальций и камнеобразование
Длительный прием препаратов кальция ассоциирован в мышлении и врачей, и пациентов с повышением риска камнеобразования. Однако доказательность этой точки зрения сомнительна. Доказано, что низкое потребление (683 мг/день) кальция у женщин в постменопаузе является фактором риска развития камней в почках [29], а высокое потребление кальция с пищей предотвращает образование камней в почках. Женщины в группе с потреблением кальция в среднем 1119 мг/сут имели достоверно меньший риск развития камней, по сравнению с группой малого потребления (43 мг/сутки), при наблюдении в течение 12 лет [21]. Аналогичные результаты опубликованы и по наблюдению за мужчинами: мужчины с высоким потреблением кальция (1326 мг/сут) имели более низкий риск развития камней, по сравнению с группой наименьшего потребления (516 мг/сутки) [20]. В исследовании Taylor среди мужчин до 60 лет риск образования камней был ниже при высоком потреблении кальция, по сравнению с мужчинами с низким содержанием кальция в диете, а у мужчин старше 60 лет количество пищевого кальция не влияло на образование камней [61, 62]. При анализе риска камнеобразования в зависимости от схемы приема препарата отмечено, что превентивное действие кальция в отношении образования оксалатных камней значительно выше при приеме солей кальция во время приема пищи [21], в то время как добавки кальция у женщин повышали риск камнеобразования на 20% при назначении приема кальция отдельно от приема пищи [19]. В исследовании по предупреждению преэклампсии, при назначении 2295 беременным женщинам 2000 мг кальция в виде карбоната кальция ежедневно, выявлено только 2 случая образования камней в почках [47]. В результате, в настоящее время считается, что низкое потребление кальция с пищей (< 700 мг/сут) является фактором риска развития камней в почках, в то время как добавления кальция к рациону питания не ассоциируется с риском развития камней в почках [3,45,61,62].
Риски камнеобразования повышаются при избыточном потреблении кальция, т. е. более 3000-4000 мг в сутки.
Кальций и кардиоваскулярная патология
Впервые о связи кардиоваскулярной патологии с кальцификацией сосудов доложил Р. Вирхов [64]. В результате многолетних наблюдений и исследований доказана взаимосвязь нарушений кальциевого гомеостаза и сердечно-сосудистой патологии и смертности, так как развитие остеопороза ассоциируется с кальцификацией коронарных сосудов, аорты и клапанов сердца [4, 12, 42, 48]. Исследование Marcovitz и соавт. выявило, что у больных с коронарной болезнью сердца (сужение артерий > 50%), подтвержденной ангиографически, отмечалось более выраженное снижение МПК в различных участках скелета по сравнению с пациентами без коронарной болезни. При этом минимальные показатели МПК регистрировались у лиц с множественным поражением коронарных артерий [48].
Jorgensen и соавт. при исследовании пациентов с острым нарушением мозгового кровообращения доказали, что снижение МПК на каждые 0,13 г/см2 удваивает риск инсульта у женщин. При дальнейших исследованиях была отмечена прямая корреляционная зависимость между кальцификацией аорты и частотой регистрации переломов позвоночника и шейки бедра [58].
Патогенетический механизм внескелетных кальцификаций может быть объяснен различными факторами, принимающими участие в костном ремоделировании в условиях дефицита кальция - избыточной продукцией паратгормона, нарушениями регуляторных влияний витамина К и витамина D, различных ростовых факторов [48, 53, 54].
Не вызывает сомнений, что в патогенезе кардиоваскулярной патологии важную роль играет воспаление и провоспалительные цитокины. Доказано, что у женщин менопауза может рассматриваться как провоспалительное состояние, характеризующееся повышением уровня С-реактивного белка [54]. В то же время, более высокие уровни С-реактивного белка выявляются у женщин со сниженной МПК в пременопаузе и постменопаузе [44]. Также определены факты взаимосвязи уровня интерлейкина-6 и МПК, остеопороза и остеопоротических переломов и уровня гомоцистеина и других биологически активных веществ [50,54,57].
В последние годы активно обсуждается вопрос о роли остеопротогерина в процессах костного ремоделирования и внескелетных нарушений при развитии остеопенических состояний и остеопороза (рис. 1). Дефицит остеопротогерина сопровождается нарушением баланса с RANKL и приводит к развитию остеопороза и кальцификаций артерий, а его введение тормозит развитие остеопороза и кальцификаций артерий [56]. Доказано, что уровень остеопротогерина нарастает в зависимости от распространенности коронарного атеросклероза, при этом отмечается прямая корреляция между его уровнем и тяжестью коронарного атеросклероза, с одной стороны, и прямая корреляционная зависимость между уровнем остеопротогерина и риском остеопоротических переломов. В последних исследованиях высказаны предположения, что остеопротогерин является независимым предиктором кардиоваскулярной смертности в популяции высокого риска [42, 51, 52].
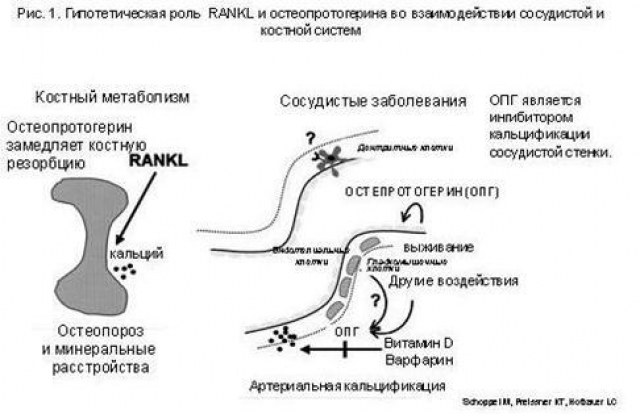
Таким образом, получены доказательства взаимосвязи дефицитарного по кальцию состояния, сопровождающегося прогрессией остеопороза, и патологии сердечно-сосудистой системы. При этом дополнительное потребление кальция уменьшает риски внескелетных кальцификаций.
Масштабное исследование, проведенное Hsia и соавт., включавшее 8-летнее наблюдение за более чем 18000 пациентов в группах сравнения, получавших кальций и плацебо, не выявило повышения риска сердечно-сосудистых событий, в том числе инфаркта миокарда, подтвержденной стенокардии, госпитализаций по поводу сердечной недостаточности, инсульта и транзиторной ишемической атаки [38]. В то же время Bolland и соавт. доложили, что при использовании кальция (п = 732) время до первого инфаркта миокарда сокращается по сравнению с плацебо (739) при наблюдении в течение 60 месяцев [8]. Очевидно, что этот критерий не может быть оценен в качестве конечной точки сердечно-сосудистого события и не является определяющим при изменении лечебных рекомендаций ни по масштабности исследования, ни по его доказательности [8].
Кальций и влияние на исходы беременности
В последние годы активно дебатируется вопрос о влиянии кальция на течение и исходы беременности. В 2006 году завершено крупное исследование, проводившееся под эгидой Всемирной организации здравоохранения по оценке добавления к рациону, содержащему мало кальция, соответствующих пищевых добавок (1,5 г/сут кальция карбоната в виде жевательных таблеток) в сравнении с плацебо. В результате отмечено снижение риска преэклампсии и более серьезных осложнений материнской и неонатальной смертности и преждевременных родов в группе, получавшей препараты кальция [63]. Механизм влияния кальция объясняют сложными взаимосвязями баланса электролитов, витамина К, остеопротогерина, паратгормона и связями с белками. Целью данной публикации не является подробный анализ влияния кальция на течение и прогноз беременности, но приведенные результаты демонстрируют позитивные эффекты кальция на исходы беременности без учета возможных влияний на состояние скелета и прогноз по МПК.
Формирование адекватной костной массы у детей и подростков также зависит от физической активности и адекватного потребления кальция, но освещение этого вопроса также не является целью данной публикации [2, 11].
Роль витамина D
Как указывалось выше, утилизация кальция возможна только при адекватной обеспеченности витамином D, который справедливо в последние годы стали называть D-гормоном [27]. Эффекты витамина D (D-гормона) включают кальциемические (влияние на фосфорно-кальциевый гомеостаз), иммуномодулирующие и общие обменные эффекты. Кальциемические эффекты витамина D опосредуют регуляцию обмена кальция и фосфора в организме, участие в минерализации костной ткани, регуляции мышечной силы, дифференцировку клеток и рост остеобластов и миелобластов (контроль процессов костного ремоделирования) и влияние на нервно-мышечную проводимость. Некальциемические эффекты результируются в различные проявления, вплоть до снижения риска развития карцином и смерти от них [28].
Ежедневная потребность в витамине D3 в среднем 400 ME, при этом 100 ME витамина D в сутки обеспечивается при регулярной инсоляции за счет фотохимического образования в коже. Образование эндогенного витамина D зависит от географической широты проживания (только до 5 мес. в году инсоляция способна обеспечивать потребности в витамине D на широте Республики Беларусь), но на интенсивность фотохимического образования оказывают влияние семейные и религиозные традиции, проживание в мегаполисах, заболевания, лимитирующие инсоляцию, и другие факторы. В табл. 3 приведены рекомендации по оптимальному потреблению витамина D в различные периоды жизни. В настоящее время опубликованы результаты многочисленных исследований, свидетельствующих о наличии дефицита витамина D (25 (ОН) D < 20 нг/мл) в различных популяциях у более чем 40% обследованных [15]. Уровень витамина D (25 (ОН) D < 20 нг/мл) менее 20 нг/мл ассоциируется с низкой плотностью кости, снижением абсорбции кальция и ухудшением функции нижних конечностей, а ниже 8 нг/мл - ассоциируется с остеомаляцией [33, 35].
Таблица 3. Рекомендуемое оптимальное потребление витамина D (ME) в различные периоды жизни (NAS, 2002)
| Возрастные и физиологические периоды | Потребление витамина Д3 |
| Дети до 6 мес | 400 |
| 6 мес – 6 лет | 400 |
| Подростки (от 14 до 18 лет) | 200-400 |
| Взрослые 19–24 лет | 200-400 |
| Взрослые 25–50 лет | 200-400 |
| Взрослые женщины в период перименопаузы | 200-400 |
| Взрослые женщины и мужчины > 50 лет | 600-800 |
| Беременные и кормящие женщины: | 200-400 |
К сожалению, в Республике Беларусь масштабных исследований по оценке обеспеченности витамином D не проводилось, но логично предположить, что обеспеченность взрослого населения Республики Беларусь не имеет принципиальных отличий от исследованных популяций, так как пищевые источники (15%) ограничены только жирной рыбой и рыбьим жиром (лосось, ставрида, треска) и искусственно обогащенной пищей (молоко, некоторые сорта мюсли), а с увеличением возраста отмечается:
• уменьшение всасывания кальция в кишечнике из молочных продуктов обусловлено снижением активности лактаз и заболеваниями желудочно-кишечного тракта с синдромом мальабсорбции;
• снижение функции почек (заболевания почек) - ухудшение превращения 25 (ОН) D в 1,25 (ОН) 2 D;
• замедление синтеза эндогенного витамина D (85%): редкое пребывание на солнце, снижение толщины дермального слоя и концентрации 7-дегидрохолестерина [33].
Исходя из приведенных данных, оптимальной рекомендуемой дозой, обеспечивающей адекватный гомеостаз кальция и витамина D в возрасте перименопаузы и старше, является 1000-1200 мг кальция и 400-800 ME витамина D3.
Исходя из данных, приведенных в табл. 4, могут быть выбраны любые соотношения солей кальция и витамина D3, соответствующие рекомендуемым с учетом потребления продуктов питания.
В то же время, для различных возрастных периодов и состояния МПК рекомендуются различные подходы в выборе препарата.
Для детей старше 3 лет в период формирования костной массы, рекомендуются минимальные адекватные дозы кальция и витамина D (см. табл. 1, 3). Подключение комплексных препаратов в этот период обосновано целесообразностью использования различных микроэлементов и витаминов для нормализации метаболических процессов в условиях распространенного дефицита витаминов и микроэлементов.
Во взрослом возрасте при профилактике развития остеопороза в группах риска рекомендуется использование 500 - 1000 мг кальция в сутки и 200 - 400 ME витамина D, а при его наличии для лечения назначают 1000 - 1500 мг кальция и 800 - 1200ME витамина D. Обоснованно считается, что для инициации использования лечебных доз кальция и витамина Д необязательно предварительное определение МПК. Индивидуальный выбор препарата должен осуществляться в соответствии с необходимости обеспечения максимальной комплаентности пациента (минимальное количество приемов лекарственного средства, удобная для пациента лекарственная форма - таблетка, жевательная таблетка, растворимая таблетка или порошок в саше, капсула), с учетом принимаемых лекарственных препаратов и стоимости. Необходимо подчеркнуть, что последние международные рекомендации отдают предпочтение не пищевому поступлению кальция, о чем указывалось выше, а использованию специальных пищевых добавок. Предпочтение добавкам, содержащим кальций, отдается по результатам нескольких мета-анализов по оценке влияния на риск переломов, но есть и еще одна точка зрения, свидетельствующая о том, что усвоение пищевого кальция находится в зависимости от целого ряда факторов, учесть которые не всегда представляется возможным (содержание в рационе белка, соли, кофеина, оксалатов, состояние желудочно-кишечного тракта и др.) [36, 49].
Таблица 4. Содержание солей кальция (мг) и витамина D3 (ME) в различных комбинированных препаратах
| Препараты | Соль кальция (мг) /Са2+ | Витамин Д3 |
| Кальций-Сандоз форте | карбонат 300 мг + лактат 2940 мг (экв. 500 мг Са2+) | -- |
| Кальцемин* | карбонат202 мг + цитрат 842 мг (250 мг Са2+) | 50 |
| Кальцемин Адванс* | карбонат 1312 мг+цитрат 217 мг (500 мг Са2+) | 200 |
| Са-Д3 Никомед | карбонат 1250 мг (500 мг Са2+) | 200 |
| Са-Д3 Никомед Форте | карбонат 1250 мг (500 мг Са2+) | 400 |
| Витрум Кальциум | карбонат 1250 мг (500 мг Са2+) | 200 |
| Кальцимакс+Д | гидроксиапатит 350 (200 мг Са2+) | 64 |
| Остеокеа | карбонат 1000 мг (500 мг Са2+) | 100 |
| Витус кальций 500 | карбонат 1250 мг (500 мг Са2+) | 100 |
| Кальций Д3-МИК форте | карбонат 416,3 мг (166,7 мг Са2+) | 133,4 |
| Кальций Д3 –МИК | карбонат 416,3 мг (166,7 мг Са2+) | 66,7 |
| Кальцивид | карбонат 1500 мг (600 мг Са2+) | 200 |
| Аскорутикаль форте* | карбонат 500 мг (200 мг Са2+) | -- |
| Кальция глюконат | глюконат 500 мг (45 мг Са2+) | -- |
| Кальция лактат | лактат 500 мг (65 мг Са2+) | -- |
| Кальциум фосфо С* | фосфат 2-основной 150 мг + пентагидрат 70 мг + глицерофосфат 50 мг (50 мг Са2+) | -- |
| Берокка кальций магний* | 100 мг Са2+ (в форме карбоната или пантетоната) | -- |
*Содержат дополнительные добавки микроэлементов и витаминов.
Спорным остается вопрос о пользе комплексных препаратов с микроэлементами и витаминами, принимающими участие в метаболических процессах, регулирующих костное ремоделирование. Несмотря на наличие экспериментальных фактов в пользу комплексных препаратов, не существует доказательной базы, подтверждающей эффективность использования микроэлементов (магния, цинка, марганца, меди, бора) в многоцентровых рандомизированных масштабных исследованиях, поэтому в современных рекомендациях эксперты воздерживаются от включения комплексных препаратов в рекомендуемые схемы лечения и профилактики остеопороза [13, 18]. Более того, положительный эффект от приема магния доказан при использовании его высоких доз (400-600 мг/сут), превышающих дозы, включенные в комплексные препараты. Цинк и магний находятся в антагонистических взаимоотношениях, так как увеличение потребления цинка сопровождается увеличением потребности в магнии и т.д. Приведенные факты диктуют необходимость дальнейшего изучения эффективности микроэлементов.
Отдельно следует остановиться на витамине К, который существует в двух видах (Кх - растительного происхождения, содержится в салате латук; К2 - животного происхождения, содержится в мясе и сырах) и играет важную роль в регуляции функции костных протеинов. В то же время, при наличии публикаций о снижении риска переломов бедра рекомендации по его использованию (например, в виде метатетрона, 45 мг/сут) носят факультативный характер [13, 39, 40, 59].
К группе комплексных препаратов может быть отнесен также оссеин-гидроксиапатитный комплекс (остеогенон), который состоит их гидроксиапатита (178 мг кальция и 82 мг фосфора) и оссеина, включающего коллаген 1 типа и неоколлагеновые пептиды (инсулиновые факторы роста I и II, трансформирующий фактор роста р). Состав оссеин-гидроксиапатитного комплекса обеспечивает позитивное влияние на ремоделирование костной ткани за счет высокой биодоступности кальция и локального влияния ростовых факторов. Доказательная база преимущественности использования остеогенона для профилактики и лечения остеопороза в настоящее время недостаточна для внесения его в рекомендации экспертов, однако этот препарат является препаратом выбора при необходимости использования добавок кальция.
Таким образом, доказательная база использования кальциевых добавок, содержащих витамин D3, неоспоримо свидетельствует об их эффективности с позиций предупреждения развития остеопороза и его базисной терапии и отсутствия убедительных данных по негативному влиянию на сердечно-сосудистую систему и камнеобразование при использовании адекватных дозировок, не превышающих 2000 мг в сутки.
Литература:
1. Руденко, 3. В. Остеопороз: диагностика, лечение и профилактика. Минск: Бел. наука, 2001. 153 с.
2. Электронный ресурс www.sign. ас. uk
3. Dietary intake and bone mineral density/ R.M. Angus [et aL] // Bone Miner. 1988. VoL 4. P. 265-277.
4. Autier, P. Vitamin D supplementation and total mortality: a meta-analysis of randomized controlled trials/ P. Autier, S. Gandini// Arch. Intern. Med. 2007. VoL 167 (16). P. 1730-1737.
5. Bischoff-Ferrari, H.A. How to select the doses of vitamin D in the management of osteoporosis//Osteoporos Int. 2007. Apr. VoL 18 (4). P. 401-407.
6. Fracture prevention with vitamin D supplementation: a meta-analysis of randomized controlled trials / H.A. Bischoff-Ferrari [et aL] //JAMA. 2005. VoL 293. P. 2257-2264.
7. Calcium intake and hip fracture risk in men and women: a meta-analysis of prospective cohort studies and randomized controlled trials 1-3 /H.A. Bischoff-Ferrari [et aL] // Am. J. Clin. Nutr. 2007. VoL 86. P. 1780-1790.
8. Vascular events in healthy older women receiving calcium supplementation: randomised controlledtrial/M. Bolland[etaL]//BMJ. 2008. Vol. 336. P. 262-266.
9. Evidence-based guidelines for the treatment of postmenopausal osteoporois: a consensus document of Belgian Bone Club/ S. Boonen [etaL] // Osteoporos Int. 2005. Vol. 16. P. 239-254.
10. Need for additional calcium to reduce the risk of hip fracture with vitamin D supplementation: evidence from a comparative metaanalysis of randomized controlled trials/S. Boonen [et aL] //JCEM. 2007. VoL 92 (4). P. 1415-1423.
11. Calcium-enriched foods and bone mass growth in prepubertal girls: a randomized, double-blind, placebo-controlled trial/J. P. Bonjour [etal.]//J. Clin. Invest. 1997. VoL 99. P. 1287-1294.
12. Relation of calcium, vitamin D and dairy food intake to ischemic heart disease mortality among postmenopausal women/R.M. Bostick[etal.]//Am.J. Epidemiol. 1999. VoL 149. P. 151-161.
13. Brown, J. B. The Scientific Advisory Council of the Osteoporosis Society of Canada: 2002 clinical practice guidelines for the diagnosis and management of osteoporosis in Canada / J.B. Brown, R.G. Josse//CMAJ. 2002. VoL 167 (suppl. 10). P. Sl-34.
14. Burckhardt, P. Calcium and vitamin D in osteoporosis: supplementation or treatment?// Calcif. Tissue Int. 2002. VoL 70. P. 74-77.
15. Prevalence of vitamin D insufficiency in an adult normal population / M.C. Chapuy [et aL]//Osteoporos Int. 1997. Vol. 7. P. 439-443.
16. Clinician's guide to prevention and treatment of osteoporosis. National Osteoporosis Foundation Bone Source. Washington, DC, 20037-1202. 2008. 36 p.
17. Calcium citrate markedly enhances aluminum absorption from aluminum hydroxide/ J.W. Coburn [etaL]//Am. J. Kidney Dis. 1991. VoL 17 (6). P. 708-711.
18. Conlan, D. Serum copper levels in elderly patients with femoral-neck fractures/ D. Conlan, R. Korula, D. Tallentire//Age Ageing. 1990. VoL 19. P. 212-214.
19. Dietary factors and the risk of incident kidney stones in younger women: Nurses'Health StudyII/G.C. Curhan [etaL]//Arch. Intern. Med. 2004. VoL 164 (8). P. 885-891.
20. A prospective study of dietary calcium and other nutrients and the risk of symptomatic kidney stones /G. C. Curhan [etal.]//N. Engl. J. Med. 1993. VoL 328 (12). P. 833-838.
21. Comparison of dietary calcium with supplemental calcium and other nutrients as factors affecting the risk for kidney stones in women/G.C. Curhan [etaL]//Ann. Intern. Med. 1997. VoL 126 (7). P. 497-504.
22. Calcium intake and fracture risk: results from the study of osteoporotic fractures / R.G. Cumming[etal.]//Am. J. Epidemiol. 1997. VoL 145 (10). P. 926-934.
23. Effect of calcium and vitamin D supplementation on bone density in men and women 65 years of age or older/B. Dawson-Hughes [etal.]//N. Engl. J. Med. VoL 337. P. 670-676.
24. A controlled trial of the effect of calcium supplementation on bone density in postmenopausal women/B. Dawson-Hughes [etal.]//N. Engl. J. Med. 1990. VoL 323. P. 878-883.
25. Dawson-Hughes, B. Calcium intake influences the association of protein intake with rates of bone loss in elderly men and women/B. Dawson-Hughes, S.S.Harris//Am. J. Clin. Nutr. 2002. VoL 75. P. 773-779.
26. Delmas, P.O. NICE recommendations for the prevention of osteoporotic fractures in postmenopausal women/P.O. Delmas, E. Sins//Bone. 2008. Vol. 42 (1). P. 16-18.
27. Effects of vitamin D metabolites on intestinal calcium absorption and bone turnover in elderly women/A. Devine [etaL]//Am. J. Clin. Nutr. 2002. VoL 75. P. 283-288.
28. Prospective study of predictors of vitamin D status and cancer incidence and mortality in men/ E. Giovannucci [etaL] //J. Natl. Cancer Inst. 2006. VoL 98. P. 451-459.
29. Risk factors for kidney stones in older women in the southern United States/ W.D. Hall [et al.]//Am. J. Med. Sci. 2001. Jul. VoL 322 (1). P. 12-18.
30. Heaney, R.P. Absorption of calcium as the carbonate and citrate salts, with some observations on method/R.P. Heaney, M.S. Dowell, M.J. Barger-Lux//Osteoporos Int. 1999. VoL 9
(1). P. 19-23.
31. Absorbability and cost effectiveness in calcium supplementation/ R. P. Heaney [et al.]// J. Am. Col. Nutr. 2001. VoL 20 (3). P. 239-246.
32. Heaney, RP. Calcium, dairy products and osteoporosis //J. Am. Coll. Nutr. 2000. Vol. 19.
P. 83S-99S.
33. Peak bone mass/ R.P. Heaney [et aL]//Osteoporos Int. 2000. VoL 11. P. 985-1009.
34. Heaney, R.P. A bsorption of calcium as the carbonate and citrate salts, with some observations on method/R.P. Heaney, M.S. Dowell, M.J. Barger-Lux//Osteoporos Int. 1999. VoL 9. P. 19-23.
35. Heaney, R. P. Phosphorus nutrition and the treatment of osteoporosis// Mayo Clin. Proc. 2004. VoL 79 (1). P. 91-97.
36. Hickey, L. Nutritional rickets: beyond the chief complaint / L. Hickey, C. Cross, M.B. Ewald//Pediatr. Emerg. Care. 2006. Feb. VoL 22 (2). P. 121-123.
37. Hickey L. [etaL]//Curr. Opin. Endocrinol. Diabetes. 2004. VoL 11. P. 18-25.
38. Calcium/vitamin D supplementation and cardiovascular events / J. Hsia [et aL] // Circulation. 2007. VoL 115. P. 846-854.
39. Iwamoto, J. Effect ofmenatetrenone on bone mineral density and incidence of vertebral fractures in postmenopausal women with osteoporosis: a comparison with the effect of etidronate/J. Iwamoto, T. Takeda, S. Ichimura//J. Orthop. Sci. 2001. VoL 6. P. 487-492.
40. Iwamoto, J. Effect of combined administration of vitamin D3 and vitamin K2 on bone mineral density of the lumbar spine in postmenopausal women with osteoporosis/J. Iwamoto, T. Takeda, S. Ichimura//J. Orthop. Sci. 2000. VoL 5. P. 546-551.
41. Calcium plus vitamin D supplementation and the risk of fractures / R.D. Jackson [et al.]// N. Engl. J. Med. 2006. VoL 354. P. 669-683.
42. Jorgensen, L Bone mineral density in acute stroke patients/L. Jorgensen, T. Engstad, B.K. Jacobsen//Stroke. 2001. VoL 32. P. 47-51.
43. European guidance for the diagnosis and management of osteoporosis in postmenopausal women/J.A. Kanis [et aL]// Osteopor. Int. 2008. VoL 19. P. 399-428.
44. Higher circulation ofhsCRP levels are associated with lower bone mineral density in health postmenopausal women: evidence for a link between systemic inflamation and osteoporosis/J.M. Koh [et aL] //Ost. Int. 10.2007/s00198-005-1840-5.
45. Double-blind, controlled calcium supplementation and bone mineral accretion in children accustomed to a low-calcium diet/ W. T. Lee [et al.]//Am. J. Clin. Nutr. 1994. Vol. 60. P. 744-750.
46. A randomized double-blind controlled calcium supplementation trial, and bone and height acquisition in children/ W.T. Lee [etal.]//Br. J. Nutr. 1995. Vol. 74. P. 125-139.
47. Trial of calcium to prevent preeclampsia/ R. Levine [et aL] // NEJM. 1997. VoL 337. P. 69-76.
48. Usefulness of bone mineral density to predict significant coronaryartery disease/ P.A. Marcovitz [et aL]//Am. J. Cardio. 2005. doilO.1016.
49. Martini, L. Relative bioavai lability of calcium-rich dietary sources in the elderly/ L. Martini, R.J. Wood//Am. J. Clin. Nutr. 2002. VoL 76 (6). P. 1345-1350.
50. McLean, R.R. Homocysteine as a predictive factor for fip fracture in older persons / R.R. McLean, P. Jacques, J. Selhub // NEJM. 2004. VoL 350. P. 20.
51. Lack of observed association between high plasma osteoprotegerin concentrations and ischemic stroke risk in a healthy population/M. Nybo [et aL]// Clin. Chem. 2008. Dec. Vol 54 (12). P. 1969-1974.
52. Nybo, M. The capability of plasma osteoprotegerin as a predictor of cardiovascular disease: a systematic literature review / M. Nybo, L.M. Rasmussen // European Journal of Endocrinology. Vol 159 (5). P. 603-608.
53. Effects of calcium supplementation on body weight and blood pressure in normal older women: a randomized controlled trial/1. R. Reid [etaL] //J. Clin. Endocrinol. Metab. 2005. VoL 90. P. 3824-2829.
54. C-reactive protein in the prediction ofcardio-vascular disease in women/ P.M. Ridker [et aL] // NEJM. 2000. VoL 342. P. 836-843.
55. Riggs, B. L A unitary model for involutional osteoporosis: estrogen deficiency causes both Type I and Type II osteoporosis in postmenopausal women and contributes to bone loss in aging men/B.L. Riggs, S. Khosla, L.J. Melton III//J. Bone Miner. Res. 1998. VoL 13. P. 763-773.
Т.В.Мохорт
Медицинская панорама. - №3 (март) 2009. с.79-85
Source: https://pharmacare.by/publications/therapy/kosti-kalcij-i-vitamin-d-tochka-ereniya-endokrinologa.html

0 Komentar